- AVEC L’AUTORISATION DES AUTEURS CM
Accès libre - Publié : 22 août 2005
Traduit par ChrissM
La chloroquine est un puissant inhibiteur de l’infection et de la propagation du coronavirus du SRAS
- Martin J Vincent ,
- Éric Bergeron ,
- Suzanne Benjannet ,
- Bobbie R Erickson ,
- Pierre E Rollin ,
- Thomas G Ksiazek ,
- Nabil G Seidah &
- Stuart T Nichol
Revue de virologie le volume 2 , Numéro d’article : 69 ( 2005 ) Citer cet article
- 1,01m Accès
- 903 citations
- 34105 Altmétrique
- Métriquedétails
Abstrait
Contexte
Le syndrome respiratoire aigu sévère (SRAS) est causé par un coronavirus nouvellement découvert (SARS-CoV). Aucun traitement prophylactique ou post-exposition efficace n’est actuellement disponible.
Résultats
Nous rapportons, cependant, que la chloroquine a de puissants effets antiviraux sur l’infection par le SRAS-CoV des cellules de primate. Ces effets inhibiteurs sont observés lorsque les cellules sont traitées avec le médicament avant ou après l’exposition au virus, suggérant un avantage à la fois prophylactique et thérapeutique. En plus des fonctions bien connues de la chloroquine telles que l’élévation du pH endosomal, le médicament semble interférer avec la glycosylation terminale du récepteur cellulaire, l’enzyme de conversion de l’angiotensine 2. Cela peut influencer négativement la liaison virus-récepteur et abroger l’infection, avec d’autres ramifications par l’élévation du pH vésiculaire, entraînant l’inhibition de l’infection et la propagation du SRAS CoV à des concentrations cliniquement admissibles.
Conclusion
La chloroquine est efficace pour prévenir la propagation du SRAS CoV en culture cellulaire. Une inhibition favorable de la propagation du virus a été observée lorsque les cellules ont été traitées avec de la chloroquine avant ou après l’infection par le SRAS CoV. En outre, le test d’immunofluorescence indirecte décrit ici représente une méthode simple et rapide pour le dépistage des composés antiviraux du SRAS-CoV.
Contexte
Le syndrome respiratoire aigu sévère (SRAS) est une maladie émergente qui a été signalée pour la première fois dans la province du Guangdong, en Chine, à la fin de 2002. La maladie s’est rapidement propagée à au moins 30 pays dans les mois qui ont suivi sa première apparition, et des efforts concertés à l’échelle mondiale ont conduit à l’identification de l’agent étiologique comme le coronavirus du SRAS (SARS-CoV), un nouveau membre de la famille des Coronaviridae [ 1 ]. Le séquençage complet du génome du SRAS-CoV [ 2 , 3 ] a confirmé que cet agent pathogène n’est étroitement lié à aucun des groupes de coronavirus précédemment établis. Le bourgeonnement du SARS-CoV se produit dans l’appareil de Golgi [ 4] et entraîne l’incorporation de la glycoprotéine de pointe d’enveloppe dans le virion. La glycoprotéine de pointe est une protéine membranaire de type I qui facilite la fixation virale au récepteur cellulaire et l’initiation de l’infection, et l’enzyme de conversion de l’angiotensine-2 (ACE2) a été identifiée comme un récepteur cellulaire fonctionnel du SRAS-CoV [ 5 ]. Nous avons récemment montré que le traitement de la protéine de pointe était effectué par des convertases de type furine et que l’inhibition de ce clivage par un inhibiteur spécifique abrogeait la cytopathie et réduisait significativement le titre viral du SRAS-CoV [ 6 ].
En raison de la gravité de l’infection par le SRAS-CoV, du potentiel de propagation rapide de la maladie et de l’absence d’ inhibiteurs in vivo efficaces et sûrs du virus, il est important d’identifier les médicaments qui peuvent être utilisés efficacement pour traiter ou prévenir les risques potentiels. Infections au SRAS-CoV. De nombreuses nouvelles approches thérapeutiques ont été évaluées dans des études de laboratoire sur le SRAS-CoV : parmi ces approches, on peut citer celles utilisant le siRNA [ 7 ], le transfert passif d’anticorps [ 8 ], la vaccination à ADN [ 9 ], le virus de la vaccine ou le virus parainfluenza exprimant la protéine de pointe [ 10 ] , 11 ], interférons [ 12 , 13], et un anticorps monoclonal dirigé contre la sous-unité S1 de la glycoprotéine de pointe qui bloque la liaison au récepteur [ 14]. Dans ce rapport, nous décrivons l’identification de la chloroquine en tant qu’agent antiviral pré- et post-infection efficace pour le SRAS-CoV. La chloroquine, une 9-aminoquinoléine identifiée en 1934, est une base faible qui augmente le pH des vésicules acides. Lorsqu’elle est ajoutée de manière extracellulaire, la partie non protonée de la chloroquine pénètre dans la cellule, où elle devient protonée et concentrée en organites acides à faible pH, tels que les endosomes, les vésicules de Golgi et les lysosomes. La chloroquine peut affecter l’infection virale de plusieurs manières, et l’effet antiviral dépend en partie de la mesure dans laquelle le virus utilise les endosomes pour entrer. La chloroquine a été largement utilisée pour traiter des maladies humaines, telles que le paludisme, l’amibiose, le VIH et les maladies auto-immunes, sans effets secondaires néfastes significatifs [ 15]. Avec les données présentées ici, montrant l’inhibition du virus dans la culture cellulaire par des doses de chloroquine compatibles avec le traitement du patient, ces caractéristiques suggèrent qu’une évaluation plus approfondie de la chloroquine dans des modèles animaux d’infection par le SRAS-CoV serait justifiée à mesure que nous progressons vers la recherche d’antiviraux efficaces pour la prévention ou le traitement. de la maladie.
Résultats
Le traitement pré-infectieux à la chloroquine rend les cellules Vero E6 réfractaires à l’infection par le SRAS-CoV
Afin de déterminer si la chloroquine pouvait prévenir l’infection par le SRAS-CoV, des cellules Vero E6 permissives [ 1 ] ont été prétraitées avec diverses concentrations de chloroquine (0,1 à 10 M) pendant 20 à 24 h avant l’infection virale. Les cellules ont ensuite été infectées par le SRAS-CoV et les antigènes viraux ont été visualisés par immunofluorescence indirecte comme décrit dans Matériels et méthodes. Examen microscopique (Fig. 1A) des cellules témoins (non traitées, infectées) ont révélé une immunocoloration étendue spécifique au SRAS-CoV de la monocouche. Une diminution dose-dépendante des cellules positives à l’antigène viral a été observée à partir de 0,1 M de chloroquine, et des concentrations de 10 M ont complètement aboli l’infection par le SRAS-CoV. À des fins quantitatives, nous avons compté le nombre de cellules colorées positives à partir de trois emplacements aléatoires sur une lame. Le nombre moyen de cellules témoins colorées positivement a été évalué à 100 % et a été comparé au nombre de cellules positives observées sous diverses concentrations de chloroquine (Fig. 1B). Le prétraitement avec 0,1, 1 et 10 M de chloroquine a réduit l’infectivité de 28 %, 53 % et 100 %, respectivement. Des résultats reproductibles ont été obtenus à partir de trois expériences indépendantes. Ces données ont démontré que le prétraitement des cellules Vero E6 avec de la chloroquine rendait ces cellules réfractaires à l’infection par le SRAS-CoV.
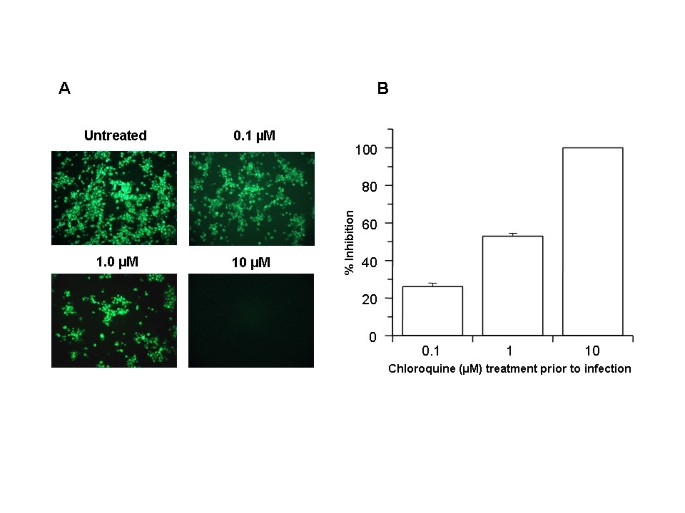
Le traitement post-infection à la chloroquine est efficace pour prévenir la propagation de l’infection par le SRAS-CoV
Afin d’étudier les propriétés antivirales de la chloroquine sur le SRAS-CoV après le début de l’infection, des cellules Vero E6 ont été infectées par le virus et un milieu frais additionné de diverses concentrations de chloroquine a été ajouté immédiatement après l’adsorption du virus. Les cellules infectées ont été incubées pendant 16 à 18 h supplémentaires, après quoi la présence d’antigènes viraux a été analysée par analyse d’immunofluorescence indirecte. Lorsque de la chloroquine a été ajoutée après le début de l’infection, il y a eu une diminution spectaculaire en fonction de la dose du nombre de cellules positives pour l’antigène viral (figure 2A ). Aussi peu que 0,1 à 1 M de chloroquine a réduit l’infection de 50 % et jusqu’à 90 à 94 % d’inhibition a été observée avec des concentrations de 33 à 100 M (Fig. 2B). À des concentrations de chloroquine supérieures à 1 M, seul un petit nombre de cellules individuelles a été initialement infecté et la propagation de l’infection aux cellules adjacentes a été pratiquement éliminée. On a estimé qu’un effet inhibiteur semi-maximal se produisait à 4,4 ± 1,0 M de chloroquine (Fig. 2C ). Ces données montrent clairement que l’ajout de chloroquine peut réduire efficacement l’établissement de l’infection et la propagation du SRAS-CoV si le médicament est ajouté immédiatement après l’adsorption du virus.
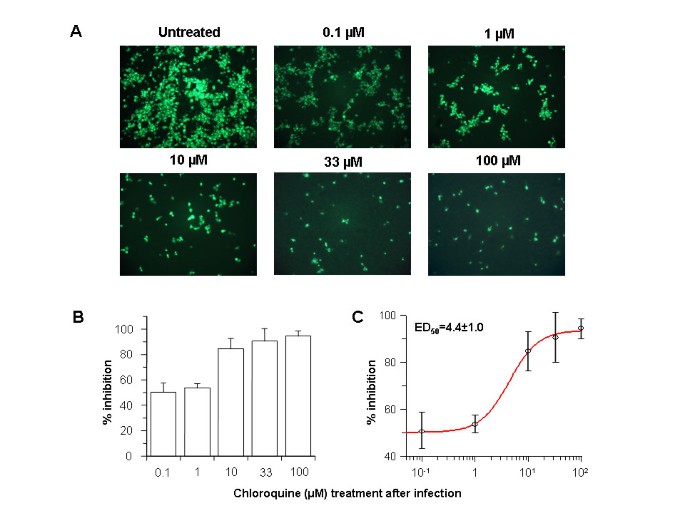
L’analyse au microscope électronique a indiqué l’apparition de quantités importantes de particules virales extracellulaires 5 à 6 heures après l’infection [ 16 ]. Comme nous avons observé des effets antiviraux de la chloroquine immédiatement après l’adsorption du virus, nous avons étendu l’analyse en ajoutant de la chloroquine 3 et 5 h après l’adsorption du virus et avons examiné la présence d’antigènes viraux après 20 h. Nous avons constaté que la chloroquine était encore significativement efficace même lorsqu’elle était ajoutée 5 h après l’infection (Fig. 3 ); cependant, pour obtenir un effet antiviral équivalent, une concentration plus élevée de chloroquine était nécessaire si le médicament était ajouté 3 ou 5 h après l’adsorption.
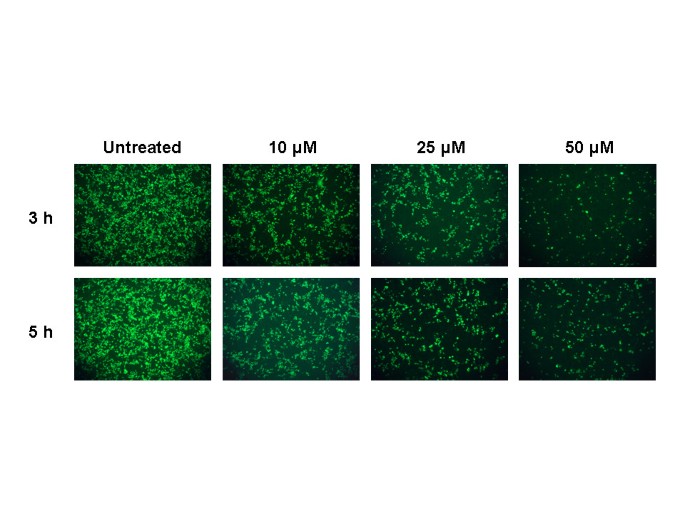
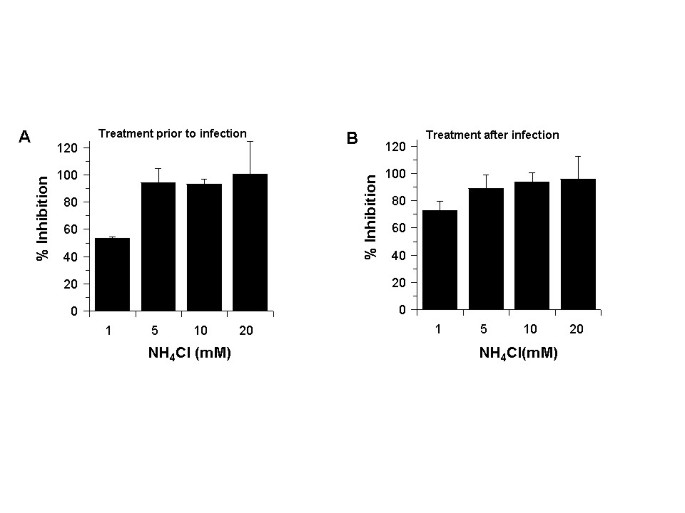
Le chlorure d’ammonium inhibe l’infection par le SRAS-CoV des cellules Vero E6
Étant donné que la chloroquine inhibe l’infection par le SRAS-CoV lorsqu’elle est ajoutée avant ou après l’infection, nous avons émis l’hypothèse qu’un autre agent lysosomotrope courant, le NH 4 Cl, pourrait également fonctionner de manière similaire. Le chlorure d’ammonium a été largement utilisé dans les études portant sur l’entrée du virus à médiation endosome. Par coïncidence, il a récemment été démontré que le NH 4 Cl réduisait la transduction des virus pseudotypiques décorés avec la protéine de pointe du SRAS-CoV [ 17 , 18 ]. Pour tenter d’examiner si le NH 4 Cl fonctionne de manière similaire à la chloroquine, nous avons effectué des analyses d’infection dans des cellules Vero E6 avant (Fig. 4A ) et après (Fig. 4B ) qu’elles aient été traitées avec différentes concentrations de NH 4Cl. Dans les deux cas, nous avons observé une inhibition de 93 à 99 % avec NH 4 Cl à ≥ 5 mM. Ces données ont indiqué que le NH 4 Cl (≥ 5 mM) et la chloroquine (≥ 10 M) sont très efficaces pour réduire l’infection par le SRAS-CoV. Ces résultats suggèrent que les effets de la chloroquine et du NH 4 Cl dans le contrôle de l’infection et de la propagation du SRAS CoV pourraient être médiés par des mécanismes similaires.
Effet de la chloroquine et du NH 4 Cl sur l’expression à la surface cellulaire de l’ACE2
Nous avons effectué des expériences supplémentaires pour élucider le mécanisme d’inhibition du SRAS-CoV par la chloroquine et le NH 4 Cl. Étant donné que le pH acide intra-vésiculaire régule les fonctions cellulaires, y compris la réduction de la N-glycosylation, le trafic cellulaire et diverses activités enzymatiques, il était intéressant de caractériser l’effet des deux médicaments sur le traitement, la glycosylation et le tri cellulaire de la glycoprotéine de pointe du SRAS-CoV et son récepteur, ACE2. L’analyse par cytométrie en flux a été réalisée sur des cellules Vero E6 non traitées ou traitées avec des concentrations anti-SRAS-CoV hautement efficaces de chloroquine ou de NH 4Cl. Les résultats ont révélé qu’aucun des deux médicaments n’avait provoqué de changement significatif dans les niveaux d’ACE2 à la surface cellulaire, indiquant que les effets inhibiteurs observés sur l’infection par le SRAS-CoV ne sont pas dus au manque d’ACE2 à la surface cellulaire disponible (Fig. 5A ). Nous avons ensuite analysé les formes moléculaires de l’ACE2 endogène dans des cellules Vero E6 non traitées et dans des cellules pré-incubées pendant 1 h avec diverses concentrations de NH 4 Cl (2,5 à 10 mM) ou de chloroquine (1 et 10 M) et marquées avec 35 S-(Met) pendant 3 h en présence ou en l’absence des médicaments (Fig. 5B et 5C ). Dans des conditions normales, nous avons observé deux formes ACE2 immunoréactives, migrant à ~ 105 et ~ 113 kDa, respectivement (Fig. 5B, voie 1). La protéine ~105-kDa est sensible à l’endoglycosidase H, suggérant qu’elle représente la forme localisée du réticulum endoplasmique (RE), tandis que la protéine ~113-kDa est résistante à l’endoglycosidase H et représente la forme modifiée par Golgi de l’ACE2 [ 19 ]. La spécificité de l’anticorps a été confirmée en déplaçant les bandes de protéines immunoréactives avec un excès d’ACE2 recombinante humaine soluble à froid (+ rhACE2 ; figure 5B , piste 2). Lorsque nous avons analysé les formes ACE2 en présence de NH 4 Cl, une nette augmentation progressive de la migration de la protéine ~113-kDa a été observée avec des concentrations croissantes de NH 4 Cl, avec un effet maximal observé à 10 mM de NH 4 Cl, résultant dans seule la forme ER de l’ACE2 étant visible sur le gel (Fig.5B , comparer les voies 3 à 5). Cela a suggéré que les modifications de rognage et/ou terminales des chaînes N-glycosylées de l’ACE2 étaient affectées par le traitement au NH 4 Cl. De plus, à 10 mM de NH 4 Cl, la forme ER de l’ACE2 a migré avec une mobilité légèrement plus rapide, indiquant que NH 4 Cl à cette concentration pourrait également affecter la glycosylation du noyau. Nous avons également examiné l’état de glycosylation terminale de l’ACE2 lorsque les cellules ont été traitées avec de la chloroquine (Fig. 5C ). Similaire à NH 4Cl, une augmentation progressive de la mobilité électrophorétique de l’ACE2 a été observée avec des concentrations croissantes de chloroquine. À 25 M de chloroquine, la mobilité électrophorétique plus rapide de la forme modifiée par Golgi de l’ACE2 était clairement évidente. Sur la base des analyses de cytométrie en flux et d’immunoprécipitation, on peut déduire que le NH 4 Cl et la chloroquine ont tous deux altéré la glycosylation terminale de l’ACE2, tandis que le NH 4 Cl a entraîné un effet plus dramatique. Bien que l’ACE2 soit exprimé en quantités similaires à la surface cellulaire, les variations de son statut de glycosylation pourraient rendre l’interaction ACE2-SARS-CoV moins efficace et inhiber l’entrée du virus lorsque les cellules sont traitées avec du NH 4 Cl et de la chloroquine.
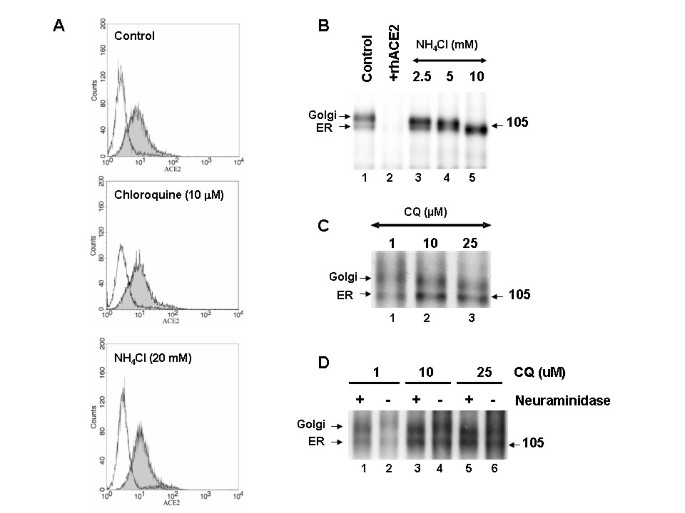
Pour confirmer que l’ ECA2 subit des modifications du sucre terminal et que le terminal de glycosylation est affectée par NH 4 Cl ou un traitement à la chloroquine, nous avons effectué immunopreipitation de 35 l’ ECA2 marqué S-et soumis à une digestion par les immunoprécipités de neuraminidase. Les protéines ont été résolues en utilisant SDS-PAGE (figure 5D ). Il est évident d’après la mobilité légèrement plus rapide de la forme de Golgi de l’ACE2 après un traitement à la neuraminidase (figure 5D , comparer les pistes 1 et 2), que l’ACE2 subit une glycosylation terminale ; cependant, la forme ER de l’ACE2 n’a pas été affectée par la neuraminidase. Les cellules traitées avec 10 M de chloroquine n’ont pas entraîné de décalage significatif ; alors que 25 M de chloroquine ont provoqué la résolution de la forme de Golgi de l’ACE2 de manière similaire à celle de l’ACE2 traitée à la neuraminidase (Fig.5D , comparer les voies 5 et 6). Ces données fournissent la preuve que l’ACE2 subit une glycosylation terminale et que la chloroquine à des concentrations anti-SRAS-CoV abroge le processus.
Effet de la chloroquine et du NH 4 Cl sur la biosynthèse et le traitement de la protéine de pointe du SRAS-CoV
Nous avons ensuite examiné si les médicaments lysosomotropes (NH 4 Cl et chloroquine) affectaient la biosynthèse, la glycosylation et/ou le trafic de la glycoprotéine de pointe du SRAS-CoV. Pour cela, des cellules Vero E6 ont été infectées par le SARS-CoV pendant 18 h. De la chloroquine ou du chlorure d’ammonium a été ajouté à ces cellules pendant qu’elles étaient affamées (1 h), marquées (30 min) ou chassées (3 h). Les lysats cellulaires ont été analysés par immunoprécipitation avec l’anticorps polyclonal spécifique du SRAS (HMAF). Les résultats d’impulsion de 30 minutes ont indiqué que le pro-spike (proS) était synthétisé en tant que précurseur de ~ 190 kDa (proS-ER) et transformé en protéines de ~ 125, ~ 105 et ~ 80 kDa (Fig. 6A , piste 2), un résultat identique à celui de notre analyse précédente [ 6 ]. A l’exception de la chloroquine 100 M (Fig.6A , piste 3), il n’y avait pas de différence significative dans la biosynthèse ou le traitement de la protéine de pointe du virus dans les cellules non traitées ou traitées à la chloroquine (Fig. 6A , pistes 4-6). Il convient de noter que la chloroquine à 100 M a entraîné une diminution globale de la biosynthèse et des niveaux de glycoprotéine virale transformée. Compte tenu de l’absence de réduction de la biosynthèse et du traitement de la glycoprotéine de pointe en présence de concentrations de chloroquine (10 et 50 M) qui ont entraîné de fortes réductions de la réplication et de la propagation du SRAS-CoV, nous concluons que l’effet antiviral n’est probablement pas dû à l’altération de la biosynthèse et du traitement des glycoprotéines virales. Des analyses similaires ont été effectuées avec NH 4Cl, et les données suggèrent que la biosynthèse et le traitement de la protéine de pointe n’étaient pas non plus affectés négativement par le NH 4 Cl (Fig. 6A , pistes 7-12). Conformément à notre analyse précédente [ 6 ], nous avons observé la présence d’une protéine plus grosse, appelée ici oligomères. Récemment, Song et al. [ 20 ] a fourni la preuve qu’il s’agit d’homotrimères de la protéine de pointe du SRAS-CoV et qu’ils ont été incorporés dans les virions. Fait intéressant, les niveaux des homotrimères dans les cellules traitées avec 100 M de chloroquine et 40 et 20 mM de NH 4 Cl (figure 6A , pistes 3, 9 et 10) étaient légèrement inférieurs à ceux des cellules témoins ou des cellules traitées avec des concentrations de médicament plus faibles.
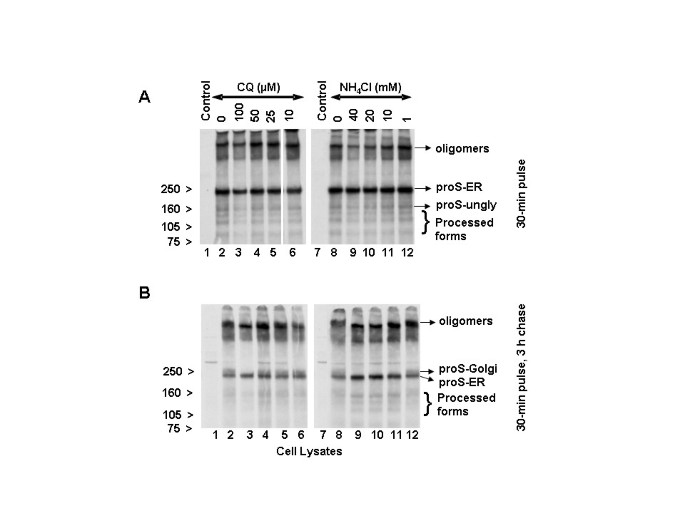
Les données obtenues à partir d’une impulsion de 30 minutes suivie d’une poursuite de 3 heures (Fig. 6B , voies 2 et 8) ont confirmé notre observation antérieure selon laquelle le précurseur de la protéine de pointe du SRAS-CoV (proS-ER) acquiert des modifications spécifiques de Golgi (proS -Golgi) résultant en une protéine d’environ 210 kDa [ 6 ]. La chloroquine à 10, 25 et 50 M n’a eu aucun impact négatif substantiel sur l’apparence de la forme de Golgi (Fig. 6B , comparer la piste 2 aux pistes 4-6). Ce n’est qu’à 100 M de chloroquine qu’une réduction du niveau du pro-spike modifié par Golgi a été observée (piste 3). D’autre part, NH 4Cl a abrogé l’apparition de formes modifiées par Golgi à ≥10 mM (comparer la piste 8 avec 9-11) et a eu un effet plus doux à 1 mM (piste 12). Ces données démontrent clairement que la biosynthèse et le traitement protéolytique de la protéine de pointe du SRAS-CoV ne sont pas affectés aux doses de chloroquine (25 et 50 M) et de NH 4 Cl (1 mM) qui provoquent des effets inhibiteurs du virus. De plus, avec 40, 20 et 10 mM de NH 4 Cl, il y avait une accumulation accrue de proS-ER avec une diminution concomitante de la quantité d’oligomères (Fig. 6B , pistes 9-11). Lorsque nous avons examiné les homotrimères, nous avons constaté que la chloroquine à 100 M et NH 4 Cl à 40 et 20 mM entraînaient une mobilité légèrement plus rapide des trimères (Fig. 6B, pistes 3, 9 et 10), mais des doses de médicament plus faibles, qui ont montré des effets antiviraux significatifs, n’ont pas entraîné de différences appréciables. Ces données suggèrent que la protéine de pointe intracellulaire nouvellement synthétisée pourrait ne pas être une cible majeure pour l’ action antivirale de la chloroquine et du NH 4 Cl. La mobilité plus rapide du trimère à une certaine concentration plus élevée des médicaments pourrait être due à l’effet de ces médicaments sur la glycosylation terminale des trimères.
Discussion
Nous avons identifié la chloroquine comme un agent antiviral efficace pour le SRAS-CoV dans des conditions de culture cellulaire, comme en témoigne son effet inhibiteur lorsque le médicament a été ajouté avant l’infection ou après le début et l’établissement de l’infection. Le fait que la chloroquine exerce un effet antiviral pendant les conditions pré- et post-infection suggère qu’elle est susceptible d’avoir des avantages à la fois prophylactiques et thérapeutiques. Récemment, Keyaerts et al. [ 21 ] ont rapporté les propriétés antivirales de la chloroquine et identifié que le médicament affecte la réplication du SRAS-CoV en culture cellulaire, comme en témoigne la RT-PCR quantitative. Conjugués aux conclusions de Keyaerts et al. [ 21], notre analyse fournit une preuve supplémentaire que la chloroquine est efficace contre les souches du SRAS-CoV Frankfurt et Urbani. Nous avons fourni des preuves que la chloroquine est efficace pour prévenir l’infection par le SRAS-CoV en culture cellulaire si le médicament est ajouté aux cellules 24 h avant l’infection. De plus, la chloroquine était significativement efficace même lorsque le médicament était ajouté 3 à 5 h après l’infection, suggérant un effet antiviral même après l’établissement de l’infection. Étant donné que des résultats similaires ont été obtenus par traitement au NH 4 Cl des cellules Vero E6, le ou les mécanismes d’action sous-jacents de ces médicaments pourraient être similaires.
Hormis le rôle probable de la chloroquine sur la réplication du SARS-CoV, les mécanismes d’action de la chloroquine sur le SARS-CoV ne sont pas totalement élucidés. Des études antérieures ont suggéré l’élévation du pH comme mécanisme par lequel la chloroquine réduit la transduction des virus de pseudotype SARS-CoV [ 17 , 18 ]. Nous avons examiné l’effet de la chloroquine et du NH 4 Cl sur les protéines de pointe du SRAS-CoV et sur son récepteur, l’ACE2. Les résultats d’immunoprécipitation de l’ACE2 ont clairement démontré que les concentrations efficaces d’anti-SRAS-CoV de chloroquine et de NH 4Cl a également altéré la glycosylation terminale de l’ACE2. Cependant, les données de cytométrie en flux ont démontré qu’il n’y a pas de différences significatives dans l’expression à la surface cellulaire de l’ACE2 dans les cellules traitées avec de la chloroquine ou du NH 4 Cl. Sur la base de ces résultats, il est raisonnable de suggérer que le prétraitement avec NH 4Le Cl ou la chloroquine ont peut-être entraîné l’expression en surface de l’ACE2 sous-glycosylée. Dans le cas d’un traitement à la chloroquine avant l’infection, l’altération de la glycosylation terminale de l’ACE2 peut entraîner une réduction des affinités de liaison entre l’ACE2 et la protéine de pointe du SRAS-CoV et influencer négativement l’initiation de l’infection par le SRAS-CoV. Étant donné que la biosynthèse, le traitement, la modification de Golgi et l’oligomérisation de la protéine de pointe nouvellement synthétisée n’ont pas été sensiblement affectés par les concentrations anti-SRAS-CoV de chloroquine ou de NH 4Cl, nous concluons que ces événements se produisent dans la cellule indépendamment de la présence des médicaments. La contribution potentielle de ces médicaments à l’élévation du pH endosomal et son impact sur l’entrée ou la sortie ultérieure du virus ne peuvent être exclus. Une diminution de la transduction du pseudotype SARS-CoV en présence de NH 4 Cl a été observée et a été attribuée à l’effet sur le pH intracellulaire [ 17 , 18 ]. Lorsque de la chloroquine ou du NH 4 Cl sont ajoutés après l’infection, ces agents peuvent rapidement augmenter le pH et renverser les événements de fusion en cours entre le virus et les endosomes, inhibant ainsi l’infection.
De plus, le mécanisme d’action du NH 4 Cl et de la chloroquine pourrait dépendre du moment où ils ont été ajoutés aux cellules. Lorsqu’ils sont ajoutés après le début de l’infection, ces médicaments peuvent affecter la fusion médiée par l’endosome, la réplication virale ultérieure ou l’assemblage et la libération. Des études antérieures sur la chloroquine ont démontré qu’elle a de multiples effets sur les cellules de mammifères en plus de l’élévation du pH endosomal, y compris la prévention de la glycosyaltion terminale des immunoglobulines [ 22 ]. Lorsqu’elle est ajoutée à des cellules infectées par le virus, la chloroquine inhibe les stades ultérieurs de la maturation du virus de la stomatite vésiculeuse en inhibant l’expression des glycoprotéines à la surface cellulaire [ 23], et il a inhibé la production de particules infectieuses du VIH-1 en interférant avec la glycosylation terminale de la glycoprotéine [ 24 , 25 ]. Sur la base de ces propriétés, nous suggérons que l’expression à la surface cellulaire de l’ACE2 sous-glycosylée et sa faible affinité pour la protéine de pointe du SRAS-CoV peuvent être le principal mécanisme par lequel l’infection est prévenue par un prétraitement médicamenteux des cellules avant l’infection. D’autre part, l’élévation rapide du pH endosomal et l’abrogation de la fusion virus-endosome peuvent être le principal mécanisme par lequel l’infection virale est empêchée dans des conditions post-traitement. Des tests plus détaillés de liaison SARS CoV spike-ACE2 en présence ou en l’absence de chloroquine seront effectués pour confirmer nos résultats. Nos études indiquent que l’impact du NH 4Le Cl et la chloroquine sur les profils ACE2 et protéiques de pointe sont significativement différents. Le NH 4 Cl présente un effet plus prononcé que la chloroquine sur la glycosylation terminale, soulignant les nouvelles différences complexes entre la chloroquine et le chlorure d’ammonium en affectant le transport des protéines ou la glycosylation de la protéine de pointe du SRAS-CoV et de son récepteur, ACE2, malgré leur similarité bien établie. effets de l’élévation du pH endosomal.
L’infectiosité des coronavirus autres que le SRAS-CoV est également affectée par la chloroquine, comme en témoigne le CoV-229E humain [ 15 ]. Les effets inhibiteurs observés sur l’infectiosité du SRAS-CoV et la propagation cellulaire se sont produits en présence de 1 à 10 M de chloroquine, qui sont des concentrations plasmatiques pouvant être atteintes pendant la prophylaxie et le traitement du paludisme (variant de 1,6 à 12,5 M) [ 26 ] et sont donc bien toléré par les patients. Il a été récemment émis l’hypothèse que la chloroquine pourrait être efficace contre le SRAS et les auteurs ont suggéré que ce composé pourrait bloquer la production de TNFα, d’IL6 ou d’IFNγ [ 15 ]. Nos données fournissent des preuves de la possibilité d’utiliser le médicament bien établi chloroquine dans la gestion clinique du SRAS.
Conclusion
La chloroquine, un médicament relativement sûr, efficace et bon marché utilisé pour traiter de nombreuses maladies humaines, notamment le paludisme, l’amibiose et le virus de l’immunodéficience humaine, est efficace pour inhiber l’infection et la propagation du SRAS CoV en culture cellulaire. Le fait que le médicament ait un effet antiviral inhibiteur significatif lorsque les cellules sensibles ont été traitées avant ou après l’infection suggère une utilisation prophylactique et thérapeutique possible.
Méthodes
Analyses d’infection par le SRAS-CoV, d’immunofluorescence et d’immunoprécipitation
Des cellules Vero E6 (une lignée cellulaire de rein de singe vert africain) ont été infectées par le SRAS-CoV (souche Urbani) à une multiplicité d’infection de 0,5 pendant 1 h. Les cellules ont été lavées avec du PBS puis incubées dans OPTI-MEM (Invitrogen) milieu avec ou sans diverses concentrations de chloroquine ou de NH 4 Cl (tous deux de Sigma). La coloration par immunofluorescence a été réalisée avec du liquide d’ascite de souris hyperimmune spécifique au SRAS-CoV (HMAF) [ 8 ] suivi d’un anticorps couplé à la fluorescéine anti-souris.
Dix-huit heures après l’infection, les surnageants contenant le virus ont été éliminés et les cellules ont été puisées avec du 35 S-(Cys) pendant 30 min et chassées pendant 3 h avant la lyse dans du tampon RIPA. Les lysats cellulaires clarifiés et les milieux ont été incubés avec du HMAF, et les protéines immunoprécipitées ont été séparées par 3 à 8 % de gel NuPAGE (Invitrogen) ; les protéines ont été visualisées par autoradiographie. Dans certaines expériences, les cellules ont été chassées pendant 3 h avec un milieu sans isotope. Les surnageants cellulaires clarifiés ont également été immunoprécipités avec du HMAF spécifique au SRAS-CoV.
Analyse et biosynthèse par cytométrie en flux ACE2
Des cellules Vero E6 ont été ensemencées dans du milieu Eagle modifié de Dulbecco (Invitrogen) additionné de 10 % de sérum bovin foetal. Le lendemain, les cellules ont été incubées dans Opti-MEM (Invitrogen) en présence ou non de 10 µM de chloroquine ou 20 mM de NH 4 Cl. Pour analyser les niveaux d’ACE2 à la surface cellulaire, les cellules ont été incubées sur de la glace avec 10 g/mL d’anticorps anti-ACE2 de chèvre purifié par affinité (R&D Systems), puis incubées avec un anticorps IgG de porc anti-chèvre marqué FITC (Caltag Laboratories) . Les cellules marquées ont été analysées par cytométrie en flux avec un cytomètre en flux FACSCalibur (BD Biosciences). Pour les études de biosynthèse de l’ACE2, les cellules Vero E6 ont été puisées avec 250 μCi 35 S-(Met) (Perkin Elmer) pendant 3 h avec les concentrations indiquées de chloroquine ou de NH 4Cl puis lysé en tampon RIPA. Les lysats clarifiés ont été immunoprécipités avec un anticorps de chèvre anti-ACE2 purifié par affinité (systèmes R&D), et les protéines immunoprécipitées ont été séparées par électrophorèse sur gel de SDS-polyacrylamide.
Les références
- 1.Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, Tong S, Urbani C, Comer JA, Lim W, Rollin PE, Dowell SF, Ling AE, Humphrey CD, Shieh WJ, Guarner J, Paddock CD , Rota PB, Fields B, DeRisi J, Yang JY, Cox N, Hughes J, LeDuc JW, Bellini WJ, Anderson LJ, Groupe de travail sur le SRAS : un nouveau coronavirus associé au syndrome respiratoire aigu sévère. N Engl J Med 2003, 348 : 1953-1966. 10.1056/NEJMoa030781CAS Article PubMed Google Scholar
- 2.Marra MA, Jones SJ, Astell CR, Holt RA, Brooks-Wilson A, Butterfield YS, Khattra J, Asano JK, Barber SA, Chan SY, Cloutier A, Coughlin SM, Freeman D, Girn N, Griffith OL, Leach SR, Mayo , McDonald H, Montgomery SB, Pandoh PK, Petrescu AS, Robertson AG, Schein JE, Siddiqui A, Smailus DE, Stott JM, Yang GS, Plummer F, Andonov A, Artsob H, Bastien N, Bernard K, Booth TF, Bowness D, Czub M, Drebot M, Fernando L, Flick R, Garbutt M, Gray M, Grolla A, Jones S, Feldmann H, Meyers A, Kabani A, Li Y, Normand S, Stroher U, Tipples GA, Tyler S , Vogrig R, Ward D, Watson B, Brunham RC, Krajden M, Petric M, Skowronski DM, Upton C, Roper RL : La séquence du génome du coronavirus associé au SRAS. Sciences 2003, 300 : 1399-1404. 10.1126/science.1085953CAS Article PubMed Google Scholar
- 3.Rota PA, Oberste MS, Monroe SS, Nix WA, Campagnoli R, Icenogle JP, Penaranda S, Bankamp B, Maher K, Chen MH, Tong S, Tamin A, Lowe L, Frace M, DeRisi JL, Chen Q, Wang D , Erdman DD, Peret TC, Burns C, Ksiazek TG, Rollin PE, Sanchez A, Liffick S, Holloway B, Limor J, McCaustland K, Olsen Rasmussen M, Fouchier R, Gunther S, Osterhaus AS, Drosten C, Pallansch MA, Anderson LJ, Bellini WJ : Caractérisation d’un nouveau coronavirus associé au syndrome respiratoire aigu sévère. Sciences 2003, 300 : 1394-1399. 10.1126/science.1085952CAS Article PubMed Google Scholar
- 4.Ng ML, Tan SH, Voir EE, Ooi EE, Ling AE : Croissance proliférative du coronavirus du SRAS dans les cellules Vero E6. J Gen Virol 2003, 84 : 3291-3303. 10.1099/vir.0.19505-0CAS Article PubMed Google Scholar
- 5.Li M, Moore WJ, Vasilieva N, Sui J, Wong SK, Berne MA, Somasundaran M, Sullivan JL, Luzuriaga K, Greenough TC, Choe H, Farzan M : l’ enzyme de conversion de l’angiotensine 2 est un récepteur fonctionnel du coronavirus du SRAS. Nature 2003, 426 : 450-454. 10.1038/nature02145CAS Article PubMed Google Scholar
- 6.Bergeron E, Vincent MJ, Wickham L, Hamelin J, Basak A, Nichol ST, Chrétien M, NG Seidah : Implication des proprotéines convertases dans le traitement et la propagation du coronavirus du syndrome respiratoire aigu sévère. Biochem Biophys Res Comm 2005, 326 : 554-563. 10.1016/j.bbrc.2004.11.063CAS Article PubMed Google Scholar
- 7.Zhang Y, Li T, Fu L, Yu C, Li Y, Xu X, Wang Y, Ning H, Zhang S, Chen W, Babiuk LA, Chang Z : Faire taire l’expression de la protéine de pointe du SRAS-CoV dans les cellules cultivées par interférence ARN. FEBS Lett 2004, 560 : 141-146. 10.1016/S0014-5793(04)00087-0CAS Article PubMed Google Scholar
- 8.Subbarao K, McAuliffe J, Vogel L, Fahle G, Fischer S, Tatti K, Packard M, Shieh WJ, Zaki S, Murphy B: Une infection antérieure et un transfert passif d’anticorps neutralisants empêchent la réplication du coronavirus du syndrome respiratoire aigu sévère dans les voies respiratoires de souris. J Virol 2004, 78 : 3572-3577. 10.1128/JVI.78.7.3572-3577.2004PubMed Central CAS Article PubMed Google Scholar
- 9.Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, Nabel GJ : un vaccin à ADN induit la neutralisation du coronavirus du SRAS et une immunité protectrice chez la souris. Nature 2004, 428 : 561-564. 10.1038/nature02463CAS Article PubMed Google Scholar
- dix.Bisht H, Roberts A, Vogel L, Bukreyev A, Collins PL, Murphy BR, Subbarao K, Moss B: La protéine de pointe du coronavirus du syndrome respiratoire aigu sévère exprimée par le virus de la vaccine atténué immunise de manière protectrice les souris. Proc Natl Acad Sci USA 2004, 101 : 6641-6646. 10.1073/pnas.0401939101PubMed Central CAS Article PubMed Google Scholar
- 11.Bukreyev A, Lamirande EW, Buchholz UJ, Vogel LN, Elkins WR, St. Claire M, Murphy BR, Subbarao K, Collins PL : Immunisation muqueuse des singes verts africains (Cercopithecus aethiops) avec un virus parainfluenza atténué exprimant la protéine de pointe du coronavirus du SRAS pour la prévention du SRAS. Lancet 2004, 363 : 2122-2127. 10.1016/S0140-6736(04)16501-XCAS Article PubMed Google Scholar
- 12.Sainz B Jr, Mossel EC, Peters CJ, Garry RF : L’interféron bêta et l’interféron gamma inhibent de manière synergique la réplication du coronavirus associé au syndrome respiratoire aigu sévère (SRAS-CoV). Virologie 2004, 329 : 11-17. 10.1016/j.virol.2004.08.011CAS Article PubMed Google Scholar
- 13.Stroher U, DiCaro A, Li Y, Strong JE, Aoki F, Plummer F, Jones SM, Feldmann H : Le coronavirus lié au syndrome respiratoire aigu sévère est inhibé par l’interféron-alpha. J Infect Dis 2004, 189 : 1164-1167. 10.1086/382597Article PubMed Google Scholar
- 14.Sui J, Li W, Murakami A, Tamin A, Matthews LJ, Wong SK, Moore MJ, Tallarico AS, Olurinde M, Choe H, Anderson LJ, Bellini WJ, Farzan M, Marasco WA : neutralisation puissante du syndrome respiratoire aigu sévère ( SRAS) par un mAb humain à la protéine S1 qui bloque l’association des récepteurs. Proc Natl Acad Sci USA 2004, 101 : 2536-2541. 10.1073/pnas.0307140101PubMed Central CAS Article PubMed Google Scholar
- 15.Savarino A, Boelaert JR, Cassone A, Majori G, Cauda R : Effets de la chloroquine sur les infections virales : un vieux médicament contre les maladies d’aujourd’hui ? Lancet Infect Dis 2003, 3 : 722-727. 10.1016/S1473-3099(03)00806-5CAS Article PubMed Google Scholar
- 16.Ng ML, Tan SH, voir EE, Ooi EE, Ling AE : événements précoces de l’infection par le coronavirus du SRAS dans les cellules vero. J Med Virol 2003, 71 : 323-331. 10.1002/jmv.10499CAS Article PubMed Google Scholar
- 17.Simmons G, Reeves JD, Rennekamp AJ, Amberg SM, Piefer AJ, Bates P: Caractérisation de l’entrée virale médiée par les glycoprotéines de pointe du coronavirus associé au syndrome respiratoire aigu sévère (SRAS-CoV). Proc Natl Acad Sci USA 2004, 101 : 4240-4245. 10.1073/pnas.0306446101PubMed Central CAS Article PubMed Google Scholar
- 18.Yang ZY, Huang Y, Ganesh L, Leung K, Kong WP, Schwartz O, Subbarao K, Nabel GJ: l’ entrée dépendante du pH du coronavirus du syndrome respiratoire aigu sévère est médiée par la glycoprotéine de pointe et renforcée par le transfert de cellules dendritiques via DC-SIGN . J Virol 2004, 78 : 5642-5650. 10.1128/JVI.78.11.5642-5650.2004PubMed Central CAS Article PubMed Google Scholar
- 19.Tipnis SR, Hooper NM, Hyde R, Karran E, Christie G, Turner AJ : Un homologue humain de l’enzyme de conversion de l’angiotensine. Clonage et expression fonctionnelle en tant que carboxypeptidase insensible au captopril. J Biol Chem 2000, 275 : 33238-33243. 10.1074/jbc.M002615200CAS Article PubMed Google Scholar
- 20.Song HC, Seo MY, Stadler K, Yoo BJ, Choo QL, Coates SR, Uematsu Y, Harada T, Greer CE, Polo JM, Pileri P, Eickmann M, Rappuoli R, Abrignani S, Houghton M, Han JH : Synthèse et caractérisation d’une forme oligomère native de glycoprotéine recombinante de pointe de coronavirus du syndrome respiratoire aigu sévère. J Virol 2004, 78 : 10328-10335. 10.1128/JVI.78.19.10328-10335.2004PubMed Central CAS Article PubMed Google Scholar
- 21.Keyaerts E, Vijgen L, Maes P, Neyts J, Ranst MV : inhibition in vitro du coronavirus du syndrome respiratoire aigu sévère par la chloroquine. Biochem Biophys Res Commun 2004, 323 : 264-268. 10.1016/j.bbrc.2004.08.085CAS Article PubMed Google Scholar
- 22.Thorens B, Vassalli P : La chloroquine et le chlorure d’ammonium empêchent la glycosylation terminale des immunoglobulines dans les plasmocytes sans affecter la sécrétion. Nature 1986, 321 : 618-620. 10.1038/321618a0CAS Article PubMed Google Scholar
- 23.Dille BJ, Johnson TC : Inhibition de l’expression des glycoprotéines du virus de la stomatite vésiculeuse par la chloroquine. J Gen Virol 1982, 62 : 91-103.CAS Article PubMed Google Scholar
- 24.Tsai WP, Nara PL, Kung HF, Oroszlan S : Inhibition de l’infectivité du virus de l’immunodéficience humaine par la chloroquine. AIDS Res Hum Retrovirus 1990, 6 : 481-489.CAS Article PubMed Google Scholar
- 25.Savarino A, Lucia MB, Rastrelli E, Rutella S, Golotta C, Morra E, Tamburrini E, Perno CF, Boelaert JR, Sperber K, Cauda RC : Effets anti-VIH de la chloroquine : inhibition de la glycosylation des particules virales et synergie avec les inhibiteurs de protéase . J Acquir Immune Defic Syndr 2004, 35 : 223-232.CAS Article PubMed Google Scholar
- 26.Ducharme J, Farinotti R : Pharmacocinétique clinique et métabolisme de la chloroquine. Concentrez-vous sur les avancées récentes. Clin Pharmacokinet 1996, 31 : 257-274.CAS Article PubMed Google Scholar
Remerciements
Nous remercions Claudia Chesley et Jonathan Towner pour la lecture critique du manuscrit. Ce travail a été soutenu par une subvention canadienne PENCE (T3), une subvention de groupe des IRSC #MGC 64518 et une subvention des IRSC #MGP-44363 (à NGS).
Informations sur l’auteur
Affiliations
- Special Pathogens Brach, Division of Viral and Rickettsial Diseases, Centers for Disease Control and Prevention, Atlanta, Géorgie, 1600 Clifton Road, 30333, États-UnisMartin J Vincent, Bobbie R Erickson, Pierre E Rollin, Thomas G Ksiazek & Stuart T Nichol
- Laboratoire de neuroendocrinologie biochimique, Institut de recherche clinique de Montréal, Montréal, 110, avenue des Pins Ouest, QCH2W1R7, CanadaEric Bergeron, Suzanne Benjannet & Nabil G Seidah
auteur correspondant
Informations Complémentaires
Intérêts concurrents
Le ou les auteurs déclarent ne pas avoir d’intérêts concurrents.
Contributions des auteurs
MV a réalisé toutes les expériences relatives à l’infection par le SRAS CoV et a coordonné la rédaction du manuscrit. EB et SB ont réalisé des expériences sur la biosynthèse de l’ACE2 et l’analyse FACS. BE a effectué l’acquisition des données des expériences d’immunofluorescence. PR et TK ont fourni des réactifs essentiels et révisé le manuscrit de manière critique. NS et SN ainsi que MV et EB ont participé à la planification des expériences, à l’examen et à l’interprétation des données et à l’examen critique du manuscrit. Tous les auteurs ont lu et approuvé le contenu du manuscrit.
Fichiers originaux soumis par les auteurs pour les images
Vous trouverez ci-dessous les liens vers les fichiers originaux soumis par les auteurs pour les images.
Fichier original des auteurs pour la figure 1
Fichier original des auteurs pour la figure 2
Fichier original des auteurs pour la figure 3
Fichier original des auteurs pour la figure 4
Fichier original des auteurs pour la figure 5
Fichier original des auteurs pour la figure 6
Droits et autorisations
Libre accès Cet article est publié sous licence par BioMed Central Ltd. Cet article en libre accès est distribué sous les termes de la Creative Commons Attribution License ( https://creativecommons.org/licenses/by/2.0 ), qui permet une utilisation sans restriction , la distribution et la reproduction sur tout support, à condition que l’œuvre originale soit correctement citée.
Réimpressions et autorisations
https://virologyj.biomedcentral.com/articles/10.1186/1743-422X-2-69





